Фтор - химический элемент (символ F, атомный номер 9), неметалл, который относится к группе галогенов. Это самое активное и электроотрицательное вещество. При нормальной температуре и давлении молекула фтора является бледно-желтого цвета с формулой F 2 . Как и другие галоиды, молекулярный фтор очень опасен и при контакте с кожей вызывает тяжелые химические ожоги.
Использование
Фтор и его соединения широко применяются, в т. ч. и для получения фармацевтических препаратов, агрохимикатов, горюче-смазочных материалов и текстиля. используется для травления стекла, а плазма из фтора - для производства полупроводниковых и других материалов. Низкие концентрации ионов F в зубной пасте и питьевой воде могут помочь предотвратить кариес зубов, в то время как более высокие концентрации входят в состав некоторых инсектицидов. Многие общие анестетики представляют собой производные фторуглеводородов. Изотоп 18 F является источником позитронов для получения медицинских изображений методом позитронно-эмиссионной томографии, а гексафторид урана используется для разделения изотопов урана и получения для атомных электростанций.
История открытия
Минералы, содержащие соединения фтора, были известны за много лет до выделения этого химического элемента. Например, минерал плавиковый шпат (или флюорит), состоящий из фторида кальция, был описан в 1530 г. Георгием Агриколой. Он заметил, что его можно использовать в качестве флюса — вещества, которое помогает снизить температуру плавления металла или руды и помогает очистить нужный металл. Поэтому фтор название свое латинское название получил от слова fluere («течь»).
В 1670 году стеклодув Генрих Шванхард обнаружил, что стекло травится под действием фтористого кальция (плавикового шпата), обработанного кислотой. Карл Шееле и многие более поздние исследователи, в том числе Гемфри Дэви, Жозеф-Луи Гей-Люссак, Антуан Лавуазье, Луи Тенар, экспериментировали с плавиковой кислотой (HF), которую было несложно получить путем обработки CaF концентрированной серной кислотой.
В конце концов, стало понятно, что HF содержит ранее неизвестный элемент. Это вещество, однако, из-за его чрезмерной реактивности в течение многих лет выделить не удавалось. Его не только трудно отделить от соединений, но оно тут же вступает в реакцию с другими их компонентами. Выделение элементарного фтора из плавиковой кислоты чрезвычайно опасно, и ранние попытки ослепили и убили нескольких ученых. Эти люди стали известны как «мученики фтора».

Открытие и производство
Наконец, в 1886 году французскому химику Анри Муассану удалось выделить фтор путем электролиза смеси расплавленных фторидов калия и плавиковой кислоты. За это он был удостоен Нобелевской премии 1906 года в области химии. Его электролитический подход продолжает использоваться сегодня для промышленного получения данного химического элемента.
Первое масштабное производство фтора началось во время Второй мировой войны. Он требовался для одного из этапов создания атомной бомбы в рамках Манхэттенского проекта. Фтор использовался для получения гексафторида урана (UF 6), который, в свою очередь, применялся для отделения друг от друга двух изотопов 235 U и 238 U. Сегодня газообразный UF 6 необходим для получения обогащенного урана для ядерной энергетики.

Важнейшие свойства фтора
В периодической таблице элемент находится в верхней части 17 группы (бывшая группа 7А), которую называют галогенной. К другим галогенам относятся хлор, бром, йод и астат. Кроме того, F находится во втором периоде между кислородом и неоном.
Чистый фтор - это коррозионный газ (химическая формула F 2) с характерным резким запахом, который обнаруживается в концентрации 20 нл на литр объема. Как наиболее реактивный и электроотрицательный из всех элементов, он легко образует соединения с большинством из них. Фтор слишком реактивный, чтобы существовать в элементарной форме и имеет такое сродство с большинством материалов, включая кремний, что его нельзя готовить или хранить в стеклянных емкостях. Во влажном воздухе он реагирует с водой, образуя не менее опасную плавиковую кислоту.
Фтор, взаимодействуя с водородом, взрывается даже при низкой температуре и в темноте. Он бурно реагирует с водой, образуя плавиковую кислоту и газообразный кислород. Различные материалы, в том числе мелкодисперсные металлы и стекла, в струе газообразного фтора горят ярким пламенем. Кроме того, данный химический элемент образует соединения с благородными газами криптоном, ксеноном и радоном. Однако непосредственно с азотом и кислородом он не реагирует.
Несмотря на крайнюю активность фтора, сегодня стали доступны методы его безопасной обработки и транспортировки. Элемент может храниться в емкостях из стали или монеля (богатого никелем сплава), так как на поверхности этих материалов образуются фториды, которые препятствуют дальнейшей реакции.
Фториды - это вещества, в которых фтор присутствует в виде отрицательно заряженного иона (F -) в сочетании с некоторыми положительно заряженными элементами. Соединения фтора с металлами являются одними из наиболее стабильных солей. При растворении в воде они делятся на ионы. Другими формами фтора являются комплексы, например, - , и H 2 F + .

Изотопы
Существует множество изотопов данного галогена, начиная от 14 F и заканчивая 31 F. Но изотопный состав фтора включает только один из них, 19 F, который содержит 10 нейтронов, так как только он является стабильным. Радиоактивный изотоп 18 F - ценный источник позитронов.
Биологическое воздействие
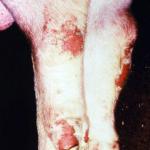
Фтор в организме в основном содержится в костях и зубах в виде ионов. Фторирование питьевой воды в концентрации менее одной части на миллион значительно снижает частоту кариеса — так считают в Национальном исследовательском совете Национальной академии наук США. С другой стороны, избыточное накопление фтора может привести к флюорозу, который проявляется в крапчатости зубов. Этот эффект обычно наблюдается в местностях, где содержание данного химического элемента в питьевой воде превышает концентрацию 10 промилле.
Элементарный фтор и фтористые соли токсичны и с ними следует обходиться с большой осторожностью. Контакта с кожей или глазами следует тщательно избегать. Реакция с кожным покровом производит которая быстро проникает через ткани и реагирует с кальцием в костях, повреждая их навсегда.

Фтор в окружающей среде
Ежегодная мировая добыча минерала флюорита составляет около 4 млн т, а общая мощность разведанных месторождений находится в пределах 120 млн т. Основными районами добычи этого минерала являются Мексика, Китай и Западная Европа.
В природе фтор встречается в земной коре, где его можно найти в горных породах, угле и глине. Фториды попадают в воздух при ветровой эрозии почв. Фтор является 13-м по распространенности химическим элементом в земной коре - его содержание равно 950 промилле. В почвах его средняя концентрация - примерно 330 промилле. Фтороводород может выделяться в воздух в результате процессов горения в промышленности. Фториды, которые находятся в воздухе, в конечном итоге выпадают на землю или в воду. Когда фтор образует связь с очень мелкими частицами, то может оставаться в воздухе в течение длительного периода времени.
В атмосфере 0,6 миллиардных долей данного химического элемента присутствуют в виде солевого тумана и органических соединений хлора. В городских условиях концентрация достигает 50 частей на миллиард.

Соединения
Фтор - это химический элемент, который образует широкий спектр органических и неорганических соединений. Химики могут заменить им атомы водорода, тем самым создавая множество новых веществ. Высокореактивный галоген образует соединения с благородными газами. В 1962 году Нил Бартлетт синтезировал гексафторплатинат ксенона (XePtF6). Фториды криптона и радона также были получены. Еще одним соединением является фторгидрид аргона, устойчивый лишь при экстремально низких температурах.
Промышленное применение
В атомарном и молекулярном состоянии фтор используется для плазменного травления в производстве полупроводников, плоских дисплеев и микроэлектромеханических систем. Плавиковая кислота применяется для травления стекла в лампах и других изделиях.
Наряду с некоторыми из его соединений, фтор - это важная составляющая производства фармацевтических препаратов, агрохимикатов, горюче-смазочных материалов и текстиля. Химический элемент необходим для получения галогенированных алканов (галоны), которые, в свою очередь, широко использовались в системах кондиционирования воздуха и охлаждения. Позже такое применение хлорфторуглеродов было запрещено, поскольку они способствуют разрушению озонового слоя в верхних слоях атмосферы.

Гексафторид серы - чрезвычайно инертный, нетоксичный газ, относящийся к веществам, вызывающим парниковый эффект. Без фтора невозможно производство пластмасс с низким коэффициентом трения, таких как тефлон. Многие анестетики (например, севофлуран, десфлуран и изофлуран) являются производными фторуглеводородов. Гексафторалюминат натрия (криолит) применяется в электролизе алюминия.
Соединения фтора, в том числе NaF, используются в зубных пастах для предотвращения кариеса. Эти вещества добавляются в системы муниципального водоснабжения для фторирования воды, однако из-за воздействия на здоровье человека эта практика считается спорной. При более высоких концентрациях NaF используются в качестве инсектицида, особенно для борьбы с тараканами.
В прошлом фториды применялись для снижения и руд и повышения их текучести. Фтор - это важный компонент производства гексафторида урана, который применяется для разделения его изотопов. 18 F, радиоактивный изотоп с 110 минут, излучает позитроны и часто используется в медицинской позитронно-эмиссионной томографии.
Физические свойства фтора
Базовые характеристики химического элемента следующие:
- Атомная масса 18,9984032 г/моль.
- Электронная конфигурация 1s 2 2s 2 2p 5 .
- Степень окисления -1.
- Плотность 1,7 г/л.
- Температура плавления 53,53 К.
- Температура кипения 85,03 К.
- Теплоемкость 31,34 Дж/(К·моль).
Фтор - довольно распространенный элемент, его кларк в земной коре составляет 6,25 - 10 2 % по массе. Этот элемент встречается в составе более чем 100 минералов. Для промышленного получения F 2 и его соединений используют флюорит CaF 2 (плавиковый шпат).
Физические свойства F 2
При об. Т - газ бледно-желтого цвета с резким запахом; х. р. в жидких водороде и кислороде.
Получить свободный фтор химическим способом невозможно, так как ни один химический окислитель не может осуществить переход
Способы получения
Для получения F 2 применяют метод электролиза расплава смеси HF и KF (KHF 2):
Электролиз: 2HF = H 2 + F 2
Химические свойства F 2
Фтор - самый сильный окислитель из всех простых веществ; непосредственно он не соединяется только с N 2 , Не, Ne, Аr, а также при обычных условиях - с O 2 .
Взаимодействие с металлами
Ме + F 2 = Me +x F -1 x (фториды)
а) со щелочными Ме - со взрывом;
б) с большинством металлов - воспламенеие;
в) с малоактивными Ме - при нагревании (при высокой температуре даже Pt горит в атмосфере F 2)
Взаимодействие с неметаллами
НеМе + F 2 = НеMeF x (фториды)
2Р + 5F 2 = 2PF 5
(реакции с S и P протекают даже при охлаждении жидким N 2)
(даже в темноте - со взрывом)
Hal 2 + F 2 = HalF x
Xe + 3F 2 = XeF 6
Взаимодействие с водой
Фтор нельзя растворить в воде и получить «фторную воду», так как он активно разлагает воду. Среди продуктов реакции обнаруживаются: фториды кислорода OF 2 , O 2 F 2 ; пероксид водорода Н 2 O 2 ; кислород, озон, фтороводород.
2F 2 + Н 2 O = OF 2 + 2HF
2F 2 + 2Н 2 О = O 2 + 4HF
Взаимодействие с SiO 2
Кварц загорается в атмосфере F 2
2F 2 + SiO 2 = SiF 4 + O 2
Фтороводород HF
Самое прочное вещество среди HHal, образовано сильно полярными молекулами.
Физические свойства
По сравнению с другими HHal имеет аномально высокие т. пл. (~83°С) и т. кип. (19,5°С). Причина - объединение молекул в прочные ассоциаты (HF) n водородными связями:
Фтороводород - бесцв. легкоподвижная и легкоиспаряющаяся жидкость с резким, удушающим запахом.
Водный р-р HF - плавиковая кислота (фтороводородная к-та)
Фтороводород обладает неограниченной растворимостью в воде; образующийся раствор имеет свойства слабой кислоты (К дисс = 6,8-10 -4). Название «плавиковая кислота» получила из-за способности растворять кварц, стекло и все силикаты.
Химические свойства
Взаимодействие с металлами
Проявляет все свойства, характерные для класса кислот.
Некоторые металлы не растворяются в плавиковой кислоте, так как образующиеся малорастворимые фториды образуют на поверхности металла защитную пленку.
Очень эффективным растворителем металлов является смесь HF и HNО 3 , в которой HNO 3 играет роль окислителя, a HF - комплексообразователя:
8HF + 2HNО 3 + W = H 2 + 2NO + 4Н 2 О
Взаимодействие с Si, SiO 2 - специфичное свойство HF
Нерастворимый в воде и в кислотах кремний реагирует с HF и смесью HF + HNО 3:
Si + 4HF → SiF 4 + 2Н 2
3Si + 12HF + 4HN0 3 → 3SiF 4 + 4N0 + 8Н 2 O
Оксид кремния Si0 2 не реагирует с водой и всеми кислотами, кроме плавиковой, в которой он медленно растворяется:
SiO 2 + 6HF → H 2 SiF 6 + 2Н 2 O
Получение HF
1. Синтез из простых веществ:
Н 2 + F 2 = 2HF
2. Действие конц. H 2 SO 4 на фториды металлов:
CaF 2 + H 2 SO 4 = CaSO 4 + 2HF
(F-F) 0,51 кДж/моль
6,54 (F-F) кДж/моль
моноклинная
(300 K) 0,028 Вт/(м·К)
| 9 | |
| 2s 2 2p 5 | |
История
Как один из атомов плавиковой кислоты элемент фтор был предсказан в 1810 году , а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода , содержащего примесь кислого фторида калия KHF 2 .
Происхождение названия
Содержанием в почве фтор обязан вулканическим газам , за счёт того, что в их состав обычно входит большое количество фтороводорода .
Изотопный состав
Фтор является моноизотопным элементом, так как в природе существует только один стабильный изотоп фтора 19 F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер - 18 F m . Самым долгоживущим из радиоактивных изотопов фтора является 18 F с периодом полураспада 109,771 минуты, важный источник позитронов , использующийся в позитрон-эмиссионной томографии .
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17 F | 17,0020952 | 64,5 c | β + -распад в 17 O | 5/2 | 4.722 |
| 18 F | 18,000938 | 1,83 часа | β + -распад в 18 O | 1 | |
| 19 F | 18,99840322 | Стабилен | - | 1/2 | 2.629 |
| 20 F | 19,9999813 | 11 c | β − -распад в 20 Ne | 2 | 2.094 |
| 21 F | 20,999949 | 4,2 c | β − -распад в 21 Ne | 5/2 | |
| 22 F | 22,00300 | 4,23 c | β − -распад в 22 Ne | 4 | |
| 23 F | 23,00357 | 2,2 c | β − -распад в 23 Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19 F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР -исследований молекул. Спектры ЯМР- 19 F являются достаточно характеристичными для фторорганических соединений.
Электронное строение
Электронная конфигурация атома фтора следующая: 1s 2 2s 2 2p 5 . Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора - 2 P 3/2 .
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
Кристаллическая решётка
 Фтор образует две кристаллические модификации, стабильные при атмосферном давлении:
Фтор образует две кристаллические модификации, стабильные при атмосферном давлении:
Получение
 Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного и его электролитическое разложение.
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве и их получают с помощью свободного фтора.
Лабораторный метод
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен, кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта (III) до 300 °С, разложение фторидов серебра (слишком дорого) и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40-41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом .
Физические свойства
Бледно-жёлтый газ, в малых концентрациях запах напоминает одновременно озон и хлор , очень агрессивен и ядовит .
Фтор имеет аномально низкую температуру кипения (плавления). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1) .
Химические свойства
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять в электрическом разряде кислород , образуя фторид кислорода OF 2 и диоксидифторид O 2 F 2 .
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора .
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди , алюминия и его сплавов, латуни , нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются непреодолимой для фтора пленкой фторидов ).
Применение
Фтор используется для получения:
- Фреонов - широко распространенных хладагентов .
- Фторопластов - химически инертных полимеров.
- Элегаза SF 6 - газообразного изолятора, применяемого в высоковольтной электротехнике.
- Гексафторида урана UF 6 , применяемого для разделения изотопов урана в ядерной промышленности.
- Гексафтороалюмината натрия - электролита для получения алюминия электролизом .
- Фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами.
Ракетная техника
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах . Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих ракетных топлив. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
Фторированные углеводороды (напр., перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил, флуоксетин, галоперидол и др.).
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита - Ca 5 F(PO 4) 3 . При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома , соответственно .
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50 % .
Предельно допустимая концентрация связанного фтора в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Токсикология
См. также
Напишите отзыв о статье "Фтор"
Литература
- Рысс И. Г. Химия фтора и его неорганических соединений. М. Госхимиздат, 1966 г. - 718 с.
- Некрасов Б. В. Основы общей химии. (издание третье, том 1) М. Химия, 1973 г. - 656 с.
- L. Pauling, I. Keaveny, and A.B. Robinson, J. Solid State Chem., 1970, 2, p. 225. англ. {{{1}}} - Подробнее о кристаллической структуре фтора.
Примечания
- . Проверено 14 марта 2013. .
- Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. (англ.) // Pure and Applied Chemistry . - 2013. - Vol. 85 , no. 5 . - P. 1047-1078 . - DOI :10.1351/PAC-REP-13-03-02 .
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. - М .: Большая Российская энциклопедия, 1998. - Т. 5. - 783 с. - ISBN 5-85270-310-9 .
- на сайте ИЮПАК
- Главным образом в эмали зубов
- Journal of Solid State Chemistry, Vol. 2, Issue 2, 1970, P. 225-227.
- J. Chem. Phys. 49, 1902 (1968)
- Гринвуд Н., Эрншо А. «Химия элементов» т. 2, М.: БИНОМ. Лаборатория знаний, 2008 стр. 147-148, 169 - химический синтез фтора
- Ахметов Н. С. «Общая и неорганическая химия».
- Энциклопедический словарь юного химика. Для среднего и старшего возраста. Москва, Педагогика-Пресс. 1999 год.
- По данным National Toxicology Program
- в виде фторидов и фторорганических соединений
- Н. В. Лазарев, И. Д. Гадаскина «Вредные вещества в промышленности» Том 3, страница 19.
Ссылки
| Портал «Химия » | |
| Фтор в Викисловаре | |
| Проект «Химия » |
- // Вестник РАН , 1997, том 67, N 11, с. 998-1013.
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| F | ||||||||||||||||||||||||||||||||
| Благородные газы | Свойства неизвестны | |||||||||||||||||||||||||||||||
Отрывок, характеризующий Фтор
Если цель русских состояла в том, чтобы отрезать и взять в плен Наполеона и маршалов, и цель эта не только не была достигнута, и все попытки к достижению этой цели всякий раз были разрушены самым постыдным образом, то последний период кампании совершенно справедливо представляется французами рядом побед и совершенно несправедливо представляется русскими историками победоносным.Русские военные историки, настолько, насколько для них обязательна логика, невольно приходят к этому заключению и, несмотря на лирические воззвания о мужестве и преданности и т. д., должны невольно признаться, что отступление французов из Москвы есть ряд побед Наполеона и поражений Кутузова.
Но, оставив совершенно в стороне народное самолюбие, чувствуется, что заключение это само в себе заключает противуречие, так как ряд побед французов привел их к совершенному уничтожению, а ряд поражений русских привел их к полному уничтожению врага и очищению своего отечества.
Источник этого противуречия лежит в том, что историками, изучающими события по письмам государей и генералов, по реляциям, рапортам, планам и т. п., предположена ложная, никогда не существовавшая цель последнего периода войны 1812 года, – цель, будто бы состоявшая в том, чтобы отрезать и поймать Наполеона с маршалами и армией.
Цели этой никогда не было и не могло быть, потому что она не имела смысла, и достижение ее было совершенно невозможно.
Цель эта не имела никакого смысла, во первых, потому, что расстроенная армия Наполеона со всей возможной быстротой бежала из России, то есть исполняла то самое, что мог желать всякий русский. Для чего же было делать различные операции над французами, которые бежали так быстро, как только они могли?
Во вторых, бессмысленно было становиться на дороге людей, всю свою энергию направивших на бегство.
В третьих, бессмысленно было терять свои войска для уничтожения французских армий, уничтожавшихся без внешних причин в такой прогрессии, что без всякого загораживания пути они не могли перевести через границу больше того, что они перевели в декабре месяце, то есть одну сотую всего войска.
В четвертых, бессмысленно было желание взять в плен императора, королей, герцогов – людей, плен которых в высшей степени затруднил бы действия русских, как то признавали самые искусные дипломаты того времени (J. Maistre и другие). Еще бессмысленнее было желание взять корпуса французов, когда свои войска растаяли наполовину до Красного, а к корпусам пленных надо было отделять дивизии конвоя, и когда свои солдаты не всегда получали полный провиант и забранные уже пленные мерли с голода.
Весь глубокомысленный план о том, чтобы отрезать и поймать Наполеона с армией, был подобен тому плану огородника, который, выгоняя из огорода потоптавшую его гряды скотину, забежал бы к воротам и стал бы по голове бить эту скотину. Одно, что можно бы было сказать в оправдание огородника, было бы то, что он очень рассердился. Но это нельзя было даже сказать про составителей проекта, потому что не они пострадали от потоптанных гряд.
Но, кроме того, что отрезывание Наполеона с армией было бессмысленно, оно было невозможно.
Невозможно это было, во первых, потому что, так как из опыта видно, что движение колонн на пяти верстах в одном сражении никогда не совпадает с планами, то вероятность того, чтобы Чичагов, Кутузов и Витгенштейн сошлись вовремя в назначенное место, была столь ничтожна, что она равнялась невозможности, как то и думал Кутузов, еще при получении плана сказавший, что диверсии на большие расстояния не приносят желаемых результатов.
Во вторых, невозможно было потому, что, для того чтобы парализировать ту силу инерции, с которой двигалось назад войско Наполеона, надо было без сравнения большие войска, чем те, которые имели русские.
В третьих, невозможно это было потому, что военное слово отрезать не имеет никакого смысла. Отрезать можно кусок хлеба, но не армию. Отрезать армию – перегородить ей дорогу – никак нельзя, ибо места кругом всегда много, где можно обойти, и есть ночь, во время которой ничего не видно, в чем могли бы убедиться военные ученые хоть из примеров Красного и Березины. Взять же в плен никак нельзя без того, чтобы тот, кого берут в плен, на это не согласился, как нельзя поймать ласточку, хотя и можно взять ее, когда она сядет на руку. Взять в плен можно того, кто сдается, как немцы, по правилам стратегии и тактики. Но французские войска совершенно справедливо не находили этого удобным, так как одинаковая голодная и холодная смерть ожидала их на бегстве и в плену.
В четвертых же, и главное, это было невозможно потому, что никогда, с тех пор как существует мир, не было войны при тех страшных условиях, при которых она происходила в 1812 году, и русские войска в преследовании французов напрягли все свои силы и не могли сделать большего, не уничтожившись сами.
В движении русской армии от Тарутина до Красного выбыло пятьдесят тысяч больными и отсталыми, то есть число, равное населению большого губернского города. Половина людей выбыла из армии без сражений.
И об этом то периоде кампании, когда войска без сапог и шуб, с неполным провиантом, без водки, по месяцам ночуют в снегу и при пятнадцати градусах мороза; когда дня только семь и восемь часов, а остальное ночь, во время которой не может быть влияния дисциплины; когда, не так как в сраженье, на несколько часов только люди вводятся в область смерти, где уже нет дисциплины, а когда люди по месяцам живут, всякую минуту борясь с смертью от голода и холода; когда в месяц погибает половина армии, – об этом то периоде кампании нам рассказывают историки, как Милорадович должен был сделать фланговый марш туда то, а Тормасов туда то и как Чичагов должен был передвинуться туда то (передвинуться выше колена в снегу), и как тот опрокинул и отрезал, и т. д., и т. д.
Русские, умиравшие наполовину, сделали все, что можно сделать и должно было сделать для достижения достойной народа цели, и не виноваты в том, что другие русские люди, сидевшие в теплых комнатах, предполагали сделать то, что было невозможно.
Все это странное, непонятное теперь противоречие факта с описанием истории происходит только оттого, что историки, писавшие об этом событии, писали историю прекрасных чувств и слов разных генералов, а не историю событий.
Для них кажутся очень занимательны слова Милорадовича, награды, которые получил тот и этот генерал, и их предположения; а вопрос о тех пятидесяти тысячах, которые остались по госпиталям и могилам, даже не интересует их, потому что не подлежит их изучению.
А между тем стоит только отвернуться от изучения рапортов и генеральных планов, а вникнуть в движение тех сотен тысяч людей, принимавших прямое, непосредственное участие в событии, и все, казавшиеся прежде неразрешимыми, вопросы вдруг с необыкновенной легкостью и простотой получают несомненное разрешение.
Цель отрезывания Наполеона с армией никогда не существовала, кроме как в воображении десятка людей. Она не могла существовать, потому что она была бессмысленна, и достижение ее было невозможно.
Цель народа была одна: очистить свою землю от нашествия. Цель эта достигалась, во первых, сама собою, так как французы бежали, и потому следовало только не останавливать это движение. Во вторых, цель эта достигалась действиями народной войны, уничтожавшей французов, и, в третьих, тем, что большая русская армия шла следом за французами, готовая употребить силу в случае остановки движения французов.
Русская армия должна была действовать, как кнут на бегущее животное. И опытный погонщик знал, что самое выгодное держать кнут поднятым, угрожая им, а не по голове стегать бегущее животное.
Когда человек видит умирающее животное, ужас охватывает его: то, что есть он сам, – сущность его, в его глазах очевидно уничтожается – перестает быть. Но когда умирающее есть человек, и человек любимый – ощущаемый, тогда, кроме ужаса перед уничтожением жизни, чувствуется разрыв и духовная рана, которая, так же как и рана физическая, иногда убивает, иногда залечивается, но всегда болит и боится внешнего раздражающего прикосновения.
После смерти князя Андрея Наташа и княжна Марья одинаково чувствовали это. Они, нравственно согнувшись и зажмурившись от грозного, нависшего над ними облака смерти, не смели взглянуть в лицо жизни. Они осторожно берегли свои открытые раны от оскорбительных, болезненных прикосновений. Все: быстро проехавший экипаж по улице, напоминание об обеде, вопрос девушки о платье, которое надо приготовить; еще хуже, слово неискреннего, слабого участия болезненно раздражало рану, казалось оскорблением и нарушало ту необходимую тишину, в которой они обе старались прислушиваться к незамолкшему еще в их воображении страшному, строгому хору, и мешало вглядываться в те таинственные бесконечные дали, которые на мгновение открылись перед ними.
Только вдвоем им было не оскорбительно и не больно. Они мало говорили между собой. Ежели они говорили, то о самых незначительных предметах. И та и другая одинаково избегали упоминания о чем нибудь, имеющем отношение к будущему.
Признавать возможность будущего казалось им оскорблением его памяти. Еще осторожнее они обходили в своих разговорах все то, что могло иметь отношение к умершему. Им казалось, что то, что они пережили и перечувствовали, не могло быть выражено словами. Им казалось, что всякое упоминание словами о подробностях его жизни нарушало величие и святыню совершившегося в их глазах таинства.
Беспрестанные воздержания речи, постоянное старательное обхождение всего того, что могло навести на слово о нем: эти остановки с разных сторон на границе того, чего нельзя было говорить, еще чище и яснее выставляли перед их воображением то, что они чувствовали.
Но чистая, полная печаль так же невозможна, как чистая и полная радость. Княжна Марья, по своему положению одной независимой хозяйки своей судьбы, опекунши и воспитательницы племянника, первая была вызвана жизнью из того мира печали, в котором она жила первые две недели. Она получила письма от родных, на которые надо было отвечать; комната, в которую поместили Николеньку, была сыра, и он стал кашлять. Алпатыч приехал в Ярославль с отчетами о делах и с предложениями и советами переехать в Москву в Вздвиженский дом, который остался цел и требовал только небольших починок. Жизнь не останавливалась, и надо было жить. Как ни тяжело было княжне Марье выйти из того мира уединенного созерцания, в котором она жила до сих пор, как ни жалко и как будто совестно было покинуть Наташу одну, – заботы жизни требовали ее участия, и она невольно отдалась им. Она поверяла счеты с Алпатычем, советовалась с Десалем о племяннике и делала распоряжения и приготовления для своего переезда в Москву.
Наташа оставалась одна и с тех пор, как княжна Марья стала заниматься приготовлениями к отъезду, избегала и ее.
Княжна Марья предложила графине отпустить с собой Наташу в Москву, и мать и отец радостно согласились на это предложение, с каждым днем замечая упадок физических сил дочери и полагая для нее полезным и перемену места, и помощь московских врачей.
– Я никуда не поеду, – отвечала Наташа, когда ей сделали это предложение, – только, пожалуйста, оставьте меня, – сказала она и выбежала из комнаты, с трудом удерживая слезы не столько горя, сколько досады и озлобления.
После того как она почувствовала себя покинутой княжной Марьей и одинокой в своем горе, Наташа большую часть времени, одна в своей комнате, сидела с ногами в углу дивана, и, что нибудь разрывая или переминая своими тонкими, напряженными пальцами, упорным, неподвижным взглядом смотрела на то, на чем останавливались глаза. Уединение это изнуряло, мучило ее; но оно было для нее необходимо. Как только кто нибудь входил к ней, она быстро вставала, изменяла положение и выражение взгляда и бралась за книгу или шитье, очевидно с нетерпением ожидая ухода того, кто помешал ей.
Ей все казалось, что она вот вот сейчас поймет, проникнет то, на что с страшным, непосильным ей вопросом устремлен был ее душевный взгляд.
В конце декабря, в черном шерстяном платье, с небрежно связанной пучком косой, худая и бледная, Наташа сидела с ногами в углу дивана, напряженно комкая и распуская концы пояса, и смотрела на угол двери.
Она смотрела туда, куда ушел он, на ту сторону жизни. И та сторона жизни, о которой она прежде никогда не думала, которая прежде ей казалась такою далекою, невероятною, теперь была ей ближе и роднее, понятнее, чем эта сторона жизни, в которой все было или пустота и разрушение, или страдание и оскорбление.
Она смотрела туда, где она знала, что был он; но она не могла его видеть иначе, как таким, каким он был здесь. Она видела его опять таким же, каким он был в Мытищах, у Троицы, в Ярославле.
Она видела его лицо, слышала его голос и повторяла его слова и свои слова, сказанные ему, и иногда придумывала за себя и за него новые слова, которые тогда могли бы быть сказаны.
Вот он лежит на кресле в своей бархатной шубке, облокотив голову на худую, бледную руку. Грудь его страшно низка и плечи подняты. Губы твердо сжаты, глаза блестят, и на бледном лбу вспрыгивает и исчезает морщина. Одна нога его чуть заметно быстро дрожит. Наташа знает, что он борется с мучительной болью. «Что такое эта боль? Зачем боль? Что он чувствует? Как у него болит!» – думает Наташа. Он заметил ее вниманье, поднял глаза и, не улыбаясь, стал говорить.
«Одно ужасно, – сказал он, – это связать себя навеки с страдающим человеком. Это вечное мученье». И он испытующим взглядом – Наташа видела теперь этот взгляд – посмотрел на нее. Наташа, как и всегда, ответила тогда прежде, чем успела подумать о том, что она отвечает; она сказала: «Это не может так продолжаться, этого не будет, вы будете здоровы – совсем».
Она теперь сначала видела его и переживала теперь все то, что она чувствовала тогда. Она вспомнила продолжительный, грустный, строгий взгляд его при этих словах и поняла значение упрека и отчаяния этого продолжительного взгляда.
«Я согласилась, – говорила себе теперь Наташа, – что было бы ужасно, если б он остался всегда страдающим. Я сказала это тогда так только потому, что для него это было бы ужасно, а он понял это иначе. Он подумал, что это для меня ужасно бы было. Он тогда еще хотел жить – боялся смерти. И я так грубо, глупо сказала ему. Я не думала этого. Я думала совсем другое. Если бы я сказала то, что думала, я бы сказала: пускай бы он умирал, все время умирал бы перед моими глазами, я была бы счастлива в сравнении с тем, что я теперь. Теперь… Ничего, никого нет. Знал ли он это? Нет. Не знал и никогда не узнает. И теперь никогда, никогда уже нельзя поправить этого». И опять он говорил ей те же слова, но теперь в воображении своем Наташа отвечала ему иначе. Она останавливала его и говорила: «Ужасно для вас, но не для меня. Вы знайте, что мне без вас нет ничего в жизни, и страдать с вами для меня лучшее счастие». И он брал ее руку и жал ее так, как он жал ее в тот страшный вечер, за четыре дня перед смертью. И в воображении своем она говорила ему еще другие нежные, любовные речи, которые она могла бы сказать тогда, которые она говорила теперь. «Я люблю тебя… тебя… люблю, люблю…» – говорила она, судорожно сжимая руки, стискивая зубы с ожесточенным усилием.
(по устаревшей классификации - элемент главной подгруппы VII группы), второго периода, с атомным номером 9. Обозначается символом F (лат. Fluorum). Фтор - чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество фтор (CAS-номер: 7782-41-4) при нормальных условиях - двухатомный газ (формула F 2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Очень ядовит.
История
Первое соединение фтора - флюорит (плавиковый шпат) CaF 2 - описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF 2 .
Происхождение названия
Название «фтор» (от др.-греч. φθόρος - разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «fluorum» (которое происходит, в свою очередь, от fluere - «течь», по свойству соединения фтора, флюорита (CaF 2), понижать температуру плавления руды и увеличивать текучесть расплава).
Получение
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве и их получают с помощью свободного фтора.
Физические свойства
Бледно-жёлтый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (плавления). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами кроме, разумеется, фторидов в высших степенях окисления и редких исключений - фторопластов, и с большинством из них - с горением и взрывом. К фтору при комнатной температуре устойчивы некоторые металлы за счет образования плотной плёнки фторида, тормозящей реакцию со фтором - Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
2F 2 + 2H 2 O → 4HF + O 2
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
2CoF 3 → 2CoF 2 + F 2
MnF 4 → MnF 3 + 1/2 F 2
Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF 2 и диоксидифторид O 2 F 2 .
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
ОПРЕДЕЛЕНИЕ
Фтор - элемент, относящийся к группе галогенов. Неметалл. Расположен во втором периоде VII группы A подгруппы.
Порядковый номер равен 9. Заряд ядра равен +9. Атомный вес - 18,998 а.е.м. Это единственный стабильный нуклид фтора.
Электронное строение атома фтора
Атом фтора имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы - VII (галогены) - свидетельствует о том, что на внешнем электронном уровне атома азота находится 7 валентных электронов и до завершения внешнего энергетического уровня не хватает всего одного электрона. Обладает самой высокой окислительной способностью среди всех элементов Периодической системы.
Рис. 1. Условное изображение строения атома фтора.
Электронная конфигурация основного состояния записывается следующим образом:
1s 2 2s 2 2p 5 .
Фтор - элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:

У фтора есть 3 пары спаренных электронов и один неспаренный электрон. Во всех своих соединениях фтор проявляет валентность I и степень окисления -1.
В результате взаимодействия фтор является акцептором электронов. В этом случае атом превращается в отрицательно заряженный ион (F —).